


水生所揭示鱼类天然免疫受体NOD1抗病毒作用机制
先天性免疫反应是机体防御外来病原微生物感染的第一道防线,这种快速非特异性的反应依赖于模式识别受体对病原相关分子模式的识别与结合。核苷酸寡聚化结构域样受体(Nucleotide oligomerization domain-like receptors, NLRs)家族成员NOD1是经典的抗细菌相关的胞内模式识别受体,尽管已有研究显示脊椎动物的NOD1参与机体抗病毒免疫反应,但其具体的作用机制仍不清楚。
中国科学院水生生物研究所昌鸣先研究员团队发现,在正常的生理条件下,NOD1基因的敲除显著损害促炎性细胞因子以及视黄酸诱导基因-I样受体(Retinoic acid inducible gene I like receptors, RLRs)所介导的抗病毒信号通路中关键靶基因的转录,这表明NOD1缺陷鱼已经有一个受损的免疫系统。在病毒感染的情况下,NOD1基因的敲除将影响病毒复制以及幼鱼存活。进一步研究发现,NOD1可以作为SVCV(ssRNA 病毒)的受体,识别并结合SVCV;NOD1不仅能增强MDA5a与poly I:C(dsRNA)的结合,而且能通过靶向MDA5剪接异构体和TRAF3,正调控MDA5a-MAVS和TRAF3-MAVS复合体的形成,从而诱导干扰素和干扰素刺激基因(ISGs)的产生。此外,我们的研究也显示NOD1增强MDA5与dsRNA结合、正调控MDA5-MAVS复合体形成的作用保守存在于哺乳动物中。有趣的是,鱼类MDA5剪接异构体MDA5a与MDA5b对NOD1的调控呈现截然相反的方式,MDA5a能够增强NOD1蛋白的表达,但是MDA5b却通过泛素-蛋白酶体途径降解NOD1蛋白。由于哺乳动物MDA5不存在选择性剪接,因此MDA5短型的剪接异构体对NOD1蛋白的降解作用特异存在于硬骨鱼类中。
该研究首次揭示了鱼类NOD1和MDA5剪接异构体的相互作用调控先天免疫反应的作用机制。相关研究结果于3月13日在线发表于免疫学经典期刊The Journal of Immunology,水生所博士生武小曼和助理研究员张杰为该文的共同第一作者,昌鸣先研究员为通讯作者。该研究得到中国科学院A类战略性先导科技专项(XDA24010308)、国家自然科学基金面上项目(31672687和31873046)、湖北省自然科学基金创新群体项目(2018CFA011)资助。文章链接:https://www.jimmunol.org/content/early/2020/03/12/jimmunol.1900667。
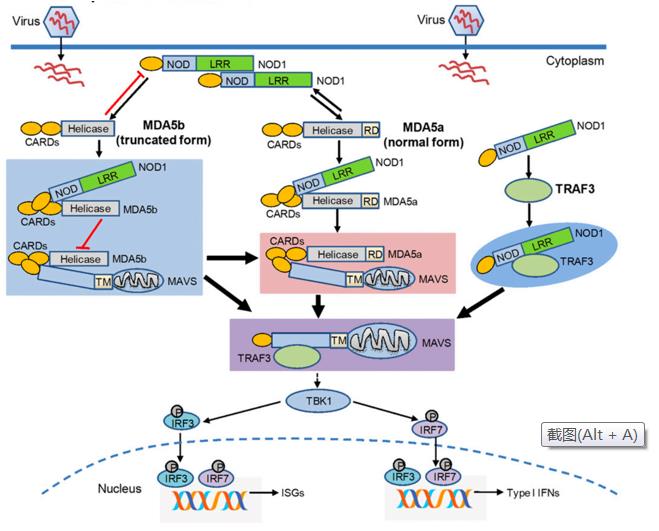
鱼类NOD1调控先天免疫反应的作用模型图
附件下载: