水生所在多倍体鲫复合种中发现倍性改变驱动生殖方式转换和基因组多样性形成
9月3日,中国科学院水生生物研究所桂建芳院士团队在Molecular Biology and Evolution在线发表了题为“Changes in ploidy drive reproduction transition and genomic diversity in a polyploid fish complex”的论文。
单性脊椎动物的起源和维持一直都是演化生物学研究的热点之一。传统观念一般认为,由于缺乏正常的减数分裂,单性动物无法通过同源重组产生遗传多样性并消除有害突变,这将最终导致其基因组衰退,从而进入进化的死胡同。有趣的是,单性脊椎动物通常存在于一些多倍体复合种中,它们存在的时间不仅远远超出了其预测的灭绝时间,还存在着丰富的遗传多样性,并表现出比其两性近缘种更强的环境适应性。然而,目前对于这些单性动物是采取何种策略避免基因组衰退还知之甚少。
多倍体鲫复合种包括有性生殖的双二倍体鲫(Carassius auratus)(AABB)和单性雌核生殖的双三倍体银鲫(Carassius gibelio)(AAABBB),双二倍体鲫通过一次近期的同源三倍化事件形成双三倍体银鲫(Wang et al., Nat Ecol Evol, 2022, 9(6):1354-1366)。该团队在前期研究中将一套双二倍体鲫的基因组(AB)整入双三倍体银鲫中,获得了少量可育的双四倍体雄鱼(A4n♂)(AAAABBBB),这些雄鱼能进行正常减数分裂并产生减半的双二倍体精子(AABB)(Lu et al., Sci China Life Sci., 2021, 64(1):77-87.);研究人员进而将双四倍体雄鱼与双二倍体鲫雌鱼回交获得了一个新双三倍体群体(NA3n)(AAABBB)。在此基础上,通过基因组重测序和染色体分型,揭示新双三倍体群体中存在着大量基因组变化,这些变化主要包括银鲫和鲫同源染色体间的重组,以及非同源染色体间的自由组合,而这些基因组的变化导致新双三倍体群体具有较高的基因组多样性。此外,该研究还详细探究了新双三倍体的育性、性别决定系统、卵母细胞成熟发育的细胞学过程以及卵子的受精行为。研究人员发现新双三倍体群体中约80%的雌鱼重新恢复了单性雌核生殖的能力,观察到其卵巢在发育过程中产生了两种类型的初级卵母细胞,揭示这两类卵母细胞具有完全不同的发育命运。类型Ⅰ卵母细胞先产生,但由于其三条同源染色体无法同时联会以及未联会染色体上的DNA双链断裂(DSB)无法修复从而发生凋亡;而随后产生的类型Ⅱ卵母细胞,其细线期几乎不形成DSB,同时三条同源染色体在减Ⅰ前期不发生联会,进而不形成重组交叉(crossover)和排出第一极体。这些现象意味着新双三倍体类型Ⅱ卵母细胞第一次减数分裂被抑制,采用与双三倍体银鲫相同的无减数分裂途径形成未减数的卵子。当这些卵子与异源精子受精时,进入卵内的精核不解凝,仅激活卵核启动发育,与双三倍体银鲫基本一致。更为重要的是,重新获得的单性雌核生殖能力能稳定地遗传给新双三倍体后代,它们的卵母细胞只以类型Ⅱ的方式发育成未减数卵子,由此产生大量稳定的新克隆系。
这些发现表明,鲫复合种的倍性改变,包括从双三倍体提升至双四倍体,再从双四倍体恢复到新双三倍体,驱动了由单性雌核生殖到有性生殖,再由有性生殖向单性雌核生殖的转变,进而通过这种改变直接导致了基因组多样性和克隆多样性的形成(图1)。总的来说,这一研究在脊椎动物多倍体复合种中揭示出一种可以产生大量克隆系的遗传演化策略,该策略可促进单性雌核生殖克隆系避免基因组衰退并增加其遗传多样性的潜能,同时为现今的银鲫遗传育种创造出丰富的种质资源并开拓出一条精准的遗传育种路径。
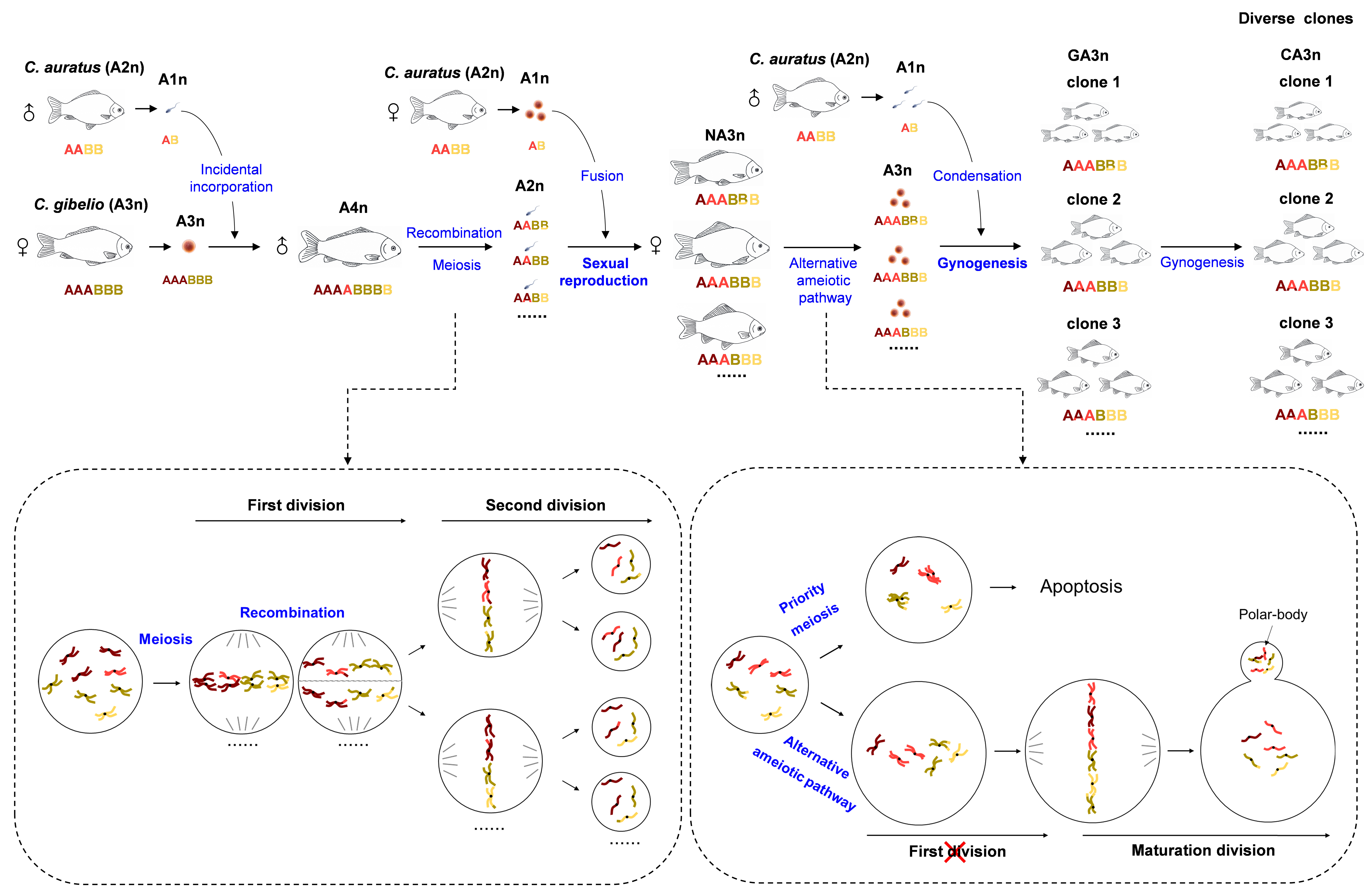
图1倍性改变导致鲫复合种有性生殖(减数分裂)与单性雌核生殖(无减数分裂途径)的转变,同时驱动克隆多样性形成
鲁蒙博士为该研究的第一作者,桂建芳院士和周莉研究员为通讯作者。研究得到国家自然科学基金重点项目(批准号:31930111)与青年项目(批准号:32102785)、中国科学院战略性先导科技专项(XDA024030104)、国家重点研发计划项目(2021YFD1200804)、 中科院特别研究助理资助项目、中国博士后基金面上项目(2021M693344) 等项目的支持。
论文链接: https://doi.org/10.1093/molbev/msac188
