水生所揭示蓝细菌中新的甲基转移酶cKMT1的功能和作用机制
赖氨酸的甲基化修饰是一种广泛存在的蛋白质翻译后修饰方式,该修饰是以S-腺苷甲硫氨酸(SAM)为甲基供体,在甲基转移酶的催化下,将甲基基团转移至赖氨酸ε-氨基上,形成甲基化的赖氨酸。甲基化修饰并不改变氨基酸的电荷状态,但甲基化残基的体积和疏水性增加会影响蛋白质-蛋白质相互作用和蛋白质识别,从而在细胞代谢等众多生物学过程中发挥重要的调控作用。虽然赖氨酸甲基化修饰与甲基转移酶最早都是在原核生物中被发现的,但是目前对于蓝细菌中的甲基转移酶仍知之甚少,发现并鉴定新的甲基转移酶及其作用底物将有助于对甲基化修饰的功能及其调控网络更全面、深入的理解。
中国科学院水生生物研究所葛峰团队前期在蓝细菌中鉴定到270个甲基化修饰蛋白,这些蛋白在光合作用以及能量代谢通路中广泛分布(Genomics Proteomics Bioinformatics,2020:S1672-0229(18) 30224-9),但在蓝细菌中仍然缺乏对甲基转移酶的系统鉴定和功能研究。近期,该研究团队对蓝细菌Synechocystis sp. PCC 6803中所有可能的甲基转移酶进行系统鉴定,通过体外甲基化反应并结合构建敲除株后的表型结果,发现了一个新的赖氨酸甲基转移酶cKMT1,该基因敲除后导致蓝细菌的光合作用过程受到显著影响,提示cKMT1调控的底物蛋白甲基化修饰可能参与了蓝细菌的光合作用进程(图1)。
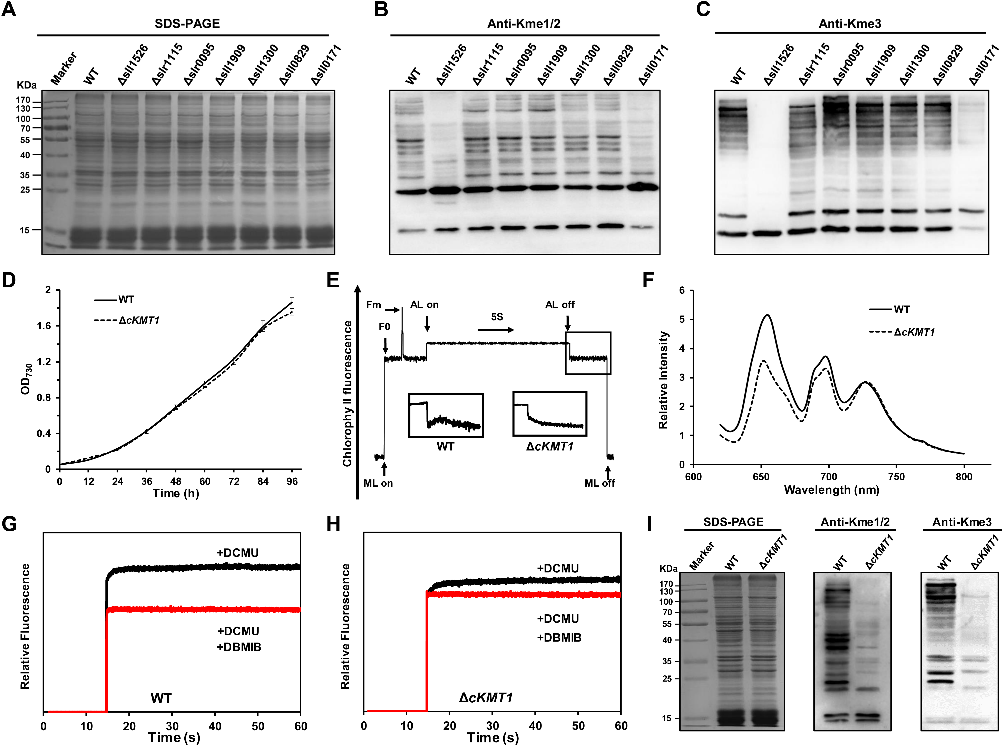
图1. 蓝细菌中甲基转移酶的鉴定与功能研究
为了揭示蓝细菌甲基转移酶cKMT1的功能作用机制,该研究团队运用了最新的4D非标记定量蛋白质组学技术,系统鉴定到58个cKMT1调控的内源性靶标蛋白,包括藻胆蛋白、光系统II、光系统I、电子传递链的核心蛋白等,它们广泛的参与了光合系统的能量传递和转化进程(图2)。
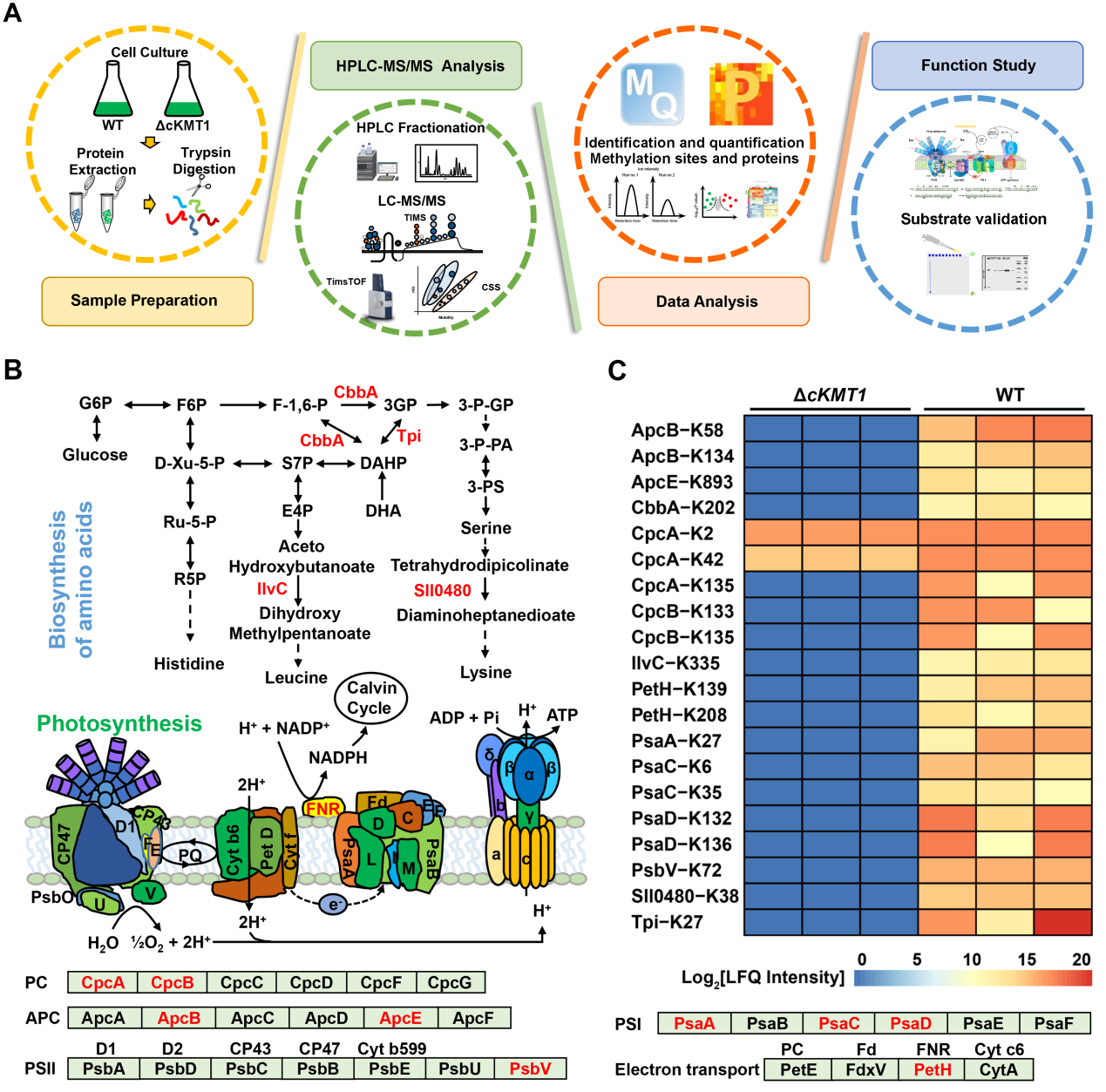
图2. cKMT1调控的内源性靶标蛋白鉴定
进一步功能实验结果表明,cKMT1能够与铁氧还蛋白(FNR)相互作用,并能够催化FNR的139位赖氨酸三甲基化和208位赖氨酸单甲基化修饰。基于结构模拟、分子对接以及动力学分析发现,cKMT1的118位的组氨酸和第219位的酪氨酸能够与甲基化供体SAM形成稳定的氢键;通过点突变实验证实,这两个位点对维持cKMT1蛋白酶活性方面发挥重要作用(图3)。
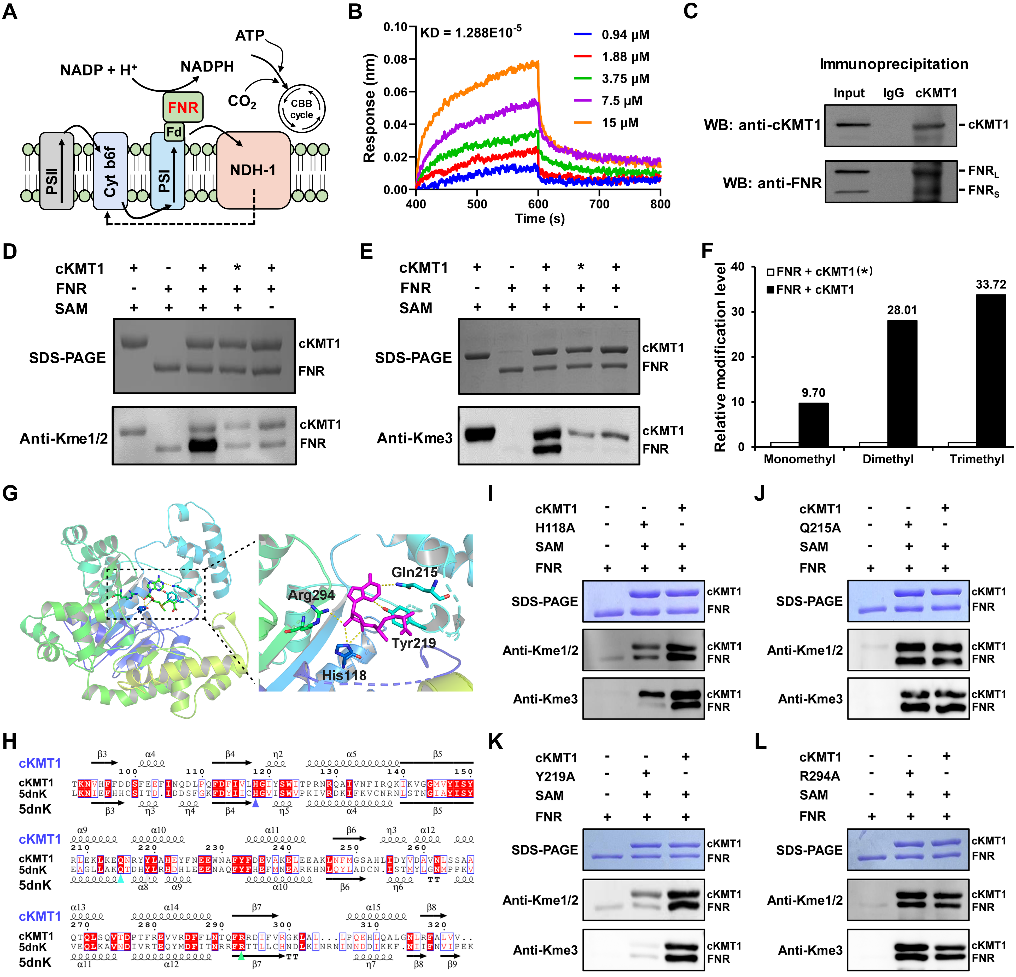
图3. cKMT1催化FNR甲基化修饰
该研究还发现cKMT1通过催化FNR蛋白139位赖氨酸甲基化修饰,改变FNR的氧化还原酶活性,并影响光合电子传递过程,揭示了cKMT1调控底物蛋白的甲基化修饰并发挥功能的作用机制(图4)。该研究首次完成了蓝细菌中甲基转移酶的系统鉴定并发现了一个全新的甲基转移酶cKMT1,阐明了cKMT1在蓝细菌中的功能与调控机制,提出了甲基转移酶通过调控底物蛋白的甲基化修饰从而影响光合作用过程的机理,为阐明蓝细菌的蛋白质翻译后修饰系统在光合作用过程中的功能及其分子调控机制打下了基础。
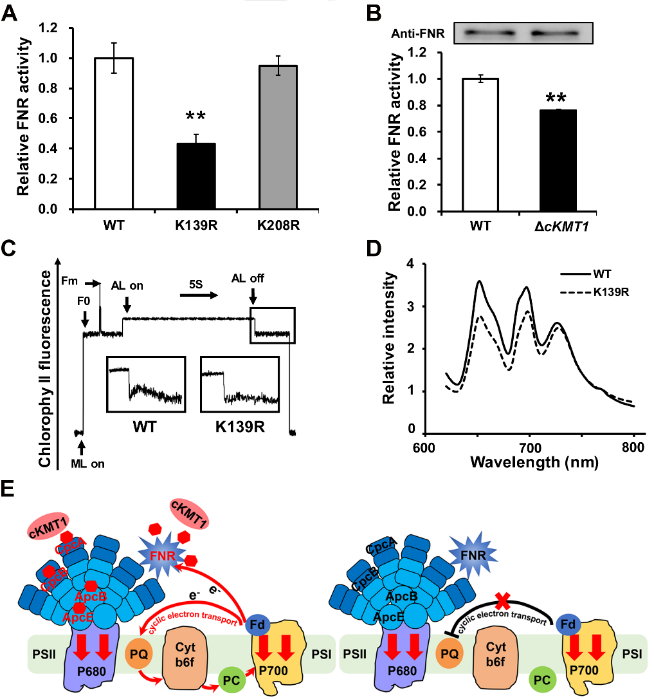
图4. cKMT1调控底物蛋白的甲基化修饰并发挥功能的作用机制
研究成果“cKMT1 is a new lysine methyltransferase that methylates the ferredoxin-NADP(+) oxidoreductase (FNR) and regulates energy transfer in cyanobacteria”在线发表于国际专业杂志Molecular & Cellular Proteomics,水生所博士生曹高祥为该论文的第一作者,葛峰研究员和杨明坤高级实验师为论文通讯作者。该研究得到自然科学基金,国家重点研发计划,中国博士后科学基金和淡水生态与生物技术国家重点实验室项目的资助。
文章链接:https://www.sciencedirect.com/science/article/pii/S1535947623000312?via%3Dihub
